Química inorgânica ou química mineral é o ramo da química que estuda os elementos químicos e as substâncias da natureza que não possuem o carbono coordenados em cadeias, investigando as suas estruturas, propriedades e a explicação do mecanismo de suas reações e transformações. Os materiais inorgânicos compreendem cerca de 95% das substâncias existentes no planeta Terra. As chamadas "substâncias inorgânicas" que servem de foco de estudo para a química inorgânica, são divididos em 4 grupos denominados como "funções inorgânicas".São eles:
1. ÁCIDO : Ácido, segundo Arrhenius (1887), é toda substância que, em solução aquosa, libera única e exclusivamente íons H+. Um exemplo é o ácido clorídrico, de fórmula HCl:
HCl 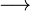 H+ + Cl –
H+ + Cl –
2 .BASES :Segundo Arrhenius, uma base (também chamada de álcali) é qualquer substância que libera única e exclusivamente o ânion OH– (íons hidroxila ou oxidrila) em solução aquosa.
3.SAIS: Composto resultante da neutralização de um ácido por uma base, com eliminação de água. É formado por um cátion proveniente de uma base e um ânion proveniente de um ácido.
4.ÓXIDOS: Óxidos são compostos binários em que o oxigênio é o elemento mais eletronegativo. O composto OF2, por exemplo, seria um óxido?
Como o flúor é o único elemento mais eletronegativo que o oxigênio, concluímos que o composto OF2 não é óxido de flúor, mas sim o fluoreto de oxigênio.
PRINCIPAIS ÁCIDOS, BASES , SAIS E ÓXIDOS E SUAS APLICAÇÕES
Ácido Clorídrico (HCl)
O HCl impuro é comercializado com o nome de ácido muriático e é um reagente muito usado na indústria e no laboratório.
É utilizado principalmente na limpeza de pisos ou de superfíceis metálicas antes da soldagem(decapagem).
O HCl encontra-se presente no estômago, no suco gástrico, conferindo a ele um pH adequado para a acção das enzimas digestivas gástricas.
Ácido Fluorídrico (HF)
O HF tem a propriedade de corroer o vidro; por isso, é usado para fazer gravações em vidros e cristais.
Ácido Sulfúrico (H2SO4)
É o ácido mais importante na indústria e no laboratório.
É utilizado nas baterias de automóvel, é consumido em enormes quantidades em inúmeros processos industriais, como processos da indústria petroquímica, na fabricação de corantes, tintas, explosivos e papel.
É tambem usado na indústria de fertilizantes agrícolas, permitindo a fabricação de produtos como os fosfatos e o sulfato de amónio.
O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele carboniza os hidratos de carbono como os açúcares, amido e celulose; a carbonização é devido à desidratação desses materiais; O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e outros materiais devido à sua enérgica ação desidratante.; O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse ácido;
As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H2SO4 e causam grande impacto ambiental.
Ácido Nítrico (HNO3)
Depois do ácido sulfúrico, é o ácido mais fabricado e mais consumido na indústria.
É usado na fabricação de explosivos como o trinitrotolueno (TNT) e a nitroglicerina (dinamite); é muito útil para a indústria de fertilizantes agrícolas, permitindo a obtenção do salitre.
O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário muito cuidado para manuseá- lo.
Ácido Cianídrico (HCN)
Ácido utilizado em indústrias diversas, como nas de plásticos, acrílicos e corantes, entre outras. Mas ele tem também um destino sinistro: nos Estados Unidos, foi usado nas "câmaras de gás" para executar pessoas condenadas à morte.
Ácido fosfórico (H3PO4)
Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura;
É usado como aditivo em alguns refrigerantes.
Ácido carbônico (H2CO3)
É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reacção do dióxido de carbono com a água:
Hidróxido de Magnésio (Mg(OH)2): Está presente na solução que é comercializada com o nome de “leite de magnésia”, produto utilizado como laxante e antiácido estomacal.
Hidróxido de Cálcio (Ca (OH)2): Conhecida como cal hidratada ou cal extinta, essa substância é usada na construção civil: na preparação de argamassa (areia + cal) e na caiação (pintura a cal); as indústrias açucareiras utilizavam o hidróxido de cálcio na purificação do açúcar comum.
Hidróxido de Amônio (NH4OH): Essa substância é obtida em solução aquosa do gás de amônia e comercializada como amoníaco. É usado na fabricação de produtos de limpeza doméstica, na revelação de filmes fotográficos, em detergentes, na indústria têxtil, etc.
Hidróxido de Potássio (KOH): Conhecida como potassa cáustica, é usada para alvejamento, na fabricação de sabões moles e no processamento de certos alimentos.
Bicarbonato de Sódio (NaHCO3) --> É usado em medicamentos que atuam como antiácidos estomacais. É também empregado como fermento na fabricação de pães, bolos, etc., uma vez que libera gás carbônico aquecido, o gás carbônico permite o crescimento da massa. É, ainda, usado para fabricar extintores de incêndio de espuma.
Carbonato de Cálcio (CaCO3) --> Componente do mármore, é usado na confecção de pisos, pias, etc. O carbonato de cálcio (calcário) é também empregado na fabricação do vidro comum e do cimento.
Sulfato de Cálcio (CaSO4) --> É um sal usado na fabricação do giz e do gesso de porcelana.
Cloreto de Sódio (NaCl) --> Este sal é intensamente usado na alimentação e também na conservação de certos alimentos; além disso, é um dos componentes do soro caseiro, usado no combate à desidratação. No sal de cozinha, além do cloreto de sódio existe uma pequena quantidade de iodeto de sódio (Nal) e de potássio (Kl). Isso previne o organismo contra o bócio ou "papo", doença que se caracteriza por um crescimento exagerado da glândula tireóide, quando a alimentação é deficiente em sais de iodo.
Fluoreto de Sódio (NaF) --> É um sal usado na fluoretação da água potável e como produto anticárie, na confecção de pasta de dente.
Nitrato de Sódio (NaNO 3) --> Conhecido como salitre do Chile, esse sal é um dos adubos (fertilizantes) nitrogenados mais comuns.
ÓXIDO :
Óxido de Cálcio (CaO): Obtido a partir da decomposição do calcário, é usado na agricultura para diminuir a acidez do solo e também na preparação de argamassa na construção civil.
Óxido Nitroso (N2O): Conhecido como gás hilariante, esse óxido inalado em pequena quantidade provoca euforia, mas pode causar sérios problemas de saúde; é utilizado como anestésico.
Dióxido de Enxofre (SO2): É usado para a obtenção de ácido sulfúrico e no branqueamento de óleos alimentícios, entre outras aplicações. É um dos principais poluentes atmosféricos; em dias úmidos, combina-se com o vapor de água da atmosfera e origina a chamada chuva ácida.
Monóxido de Carbono (CO): Usado para obter certos produtos químicos e na metalurgia do aço. É normalmente o principal poluente da atmosfera das zonas urbanas; inalado combina com a hemoglobina das hemácias do sangue, neutralizando-as para o transporte de gás oxigênio no organismo.
Fonte:
A chuva ácida, ou com mais propriedade deposição ácida, é a designação dada à chuva, ou qualquer outra forma de precipitação atmosférica, cuja acidez seja substancialmente maior do que a resultante da dissociação do dióxido de carbono (CO2) atmosférico dissolvido na água precipitada.[1]A principal causa daquela acidificação é a presença na atmosfera terrestre de gases e partículas ricos em enxofre e azoto reactivo cuja hidrólise no meio atmosférico produz ácidos fortes. Assumem particular importância os compostos azotados (NOx) gerados pelas altas temperaturas de queima dos combustíveis fósseis e os compostos de enxofre (SOx) produzidos pela oxidação das impurezas sulfurosas existentes na maior parte dos carvões e petróleos. Quimicamente, chuva ácida não seria uma expressão adequada, porque para a Química toda chuva é ácida devido à presença doácido carbônico (H2CO3), mas para a Geografia toda chuva com PH abaixo do N.T (Nível de tolerância) é considerada ácida. Ela também pode acarretar sérios danos as trutas por exemplo, uma vez que se cair uma chuva ácida num ambiente lacustre de uma truta, abaixo ou acima do N.T, a truta morrerá. Os efeitos ambientais da precipitação ácida levaram à adopção, pela generalidade dos países, de medidas legais restritivas da queima de combustíveis ricos em enxofre e obrigando à adopção de tecnologias de redução das emissões de azoto reativo para a atmosfera.
TABELA DO pH E SEU FUNCIONAMENTO
Varia de 0 a 14 ( 0 a 7 ácido/ 7 neutro/ 8 a 14 é base)
Um indicador de pH, também chamado indicador ácido-base, é um composto químico que é adicionado em pequenas quantidades a uma solução, permitindo conhecer se a solução é ácida, básica ou neutra. Estes corantes são dotados de propriedades halocrômicas, que é a capacidade de mudar de coloração em função do pH do meio. Os indicadores de pH, são frequentemente ácidos ou bases fracas. Quando adicionados a uma solução, os indicadores de pH ligam-se aosíons H+ ou OH-. A ligação a estes íons provoca uma alteração da configuração eletrônica destes indicadores e, consequentemente, altera-lhes a cor. Dada a subjectividade em determinar a mudança de cor, os indicadores de pH não são aconselháveis para determinações precisas do valor do pH. Um medidor de pH, denominado pHmetro, é frequentemente usado em aplicações onde são necessárias um maior rigor na determinação do pH da solução.
EFEITO ESTUFA
O efeito estufa um processo que ocorre quando uma parte da radiação infravermelha emitida pela superfície terrestre é absorvida por determinados gases presentes na atmosfera. Como consequência disso, o calor fica retido, não sendo libertado para o espaço. O efeito estufa dentro de uma determinada faixa é de vital importância pois, sem ele, a vida como a conhecemos não poderia existir. Serve para manter o planeta aquecido, e assim, garantir a manutenção da vida. Os gases de estufa (dióxido de carbono (CO2), metano (CH4), Óxido nitroso (N2O), CFC´s (CFxClx) absorvem alguma radiação infravermelha emitida pela superfície da Terra e radiam por sua vez alguma da energia absorvida de volta para a superfície. Como resultado, a superfície recebe quase o dobro de energia da atmosfera do que a que recebe do Sol e a superfície fica cerca de 30 °C mais quente do que estaria sem a presença dos gases «de estufa». Um dos piores gases é o metano, cerca de 20 vezes mais potente que o dióxido de carbono, é produzido pela flatulência dos ovinos ebovinos, sendo que a pecuária representa 16% da poluição mundial. Cientistas procuram a solução para esse problema e estão desenvolvendo um remédio para tentar resolver o caso. Na Nova Zelândia pensou-se em cobrar-se taxas por vaca, para compensar o efeito dos gases emitidos.[2] Ao contrário do significado literal da expressão «efeito estufa», a atmosfera terrestre não se comporta como uma estufa (ou como umcobertor). Numa estufa, o aquecimento dá-se essencialmente porque a convecção é suprimida. Não há troca de ar entre o interior e o exterior. Ora acontece que a atmosfera facilita a convecção e não armazena calor: em média, a temperatura da atmosfera é constante e a energia absorvida transforma-se imediatamente na energia cinética e potencial das moléculas que existem na atmosfera. A atmosfera não reflete a energia radiada pela Terra. Os seus gases, principalmente o dióxido de carbono, absorvem-na. E se radia, é apenas porque tem uma temperatura finita e não por ter recebido radiação. A radiação que emite nada tem que ver com a que foi absorvida. Tem um espectro completamente diferente.
O efeito estufa, embora seja prejudicial em excesso, é na verdade vital para a vida na Terra, pois é ele que mantém as condições ideais para a manutenção da vida, com temperaturas mais amenas e adequadas. Porém, o excesso dos gases responsáveis pelo Efeito Estufa, ao qual desencadeia um fenómeno conhecido como Aquecimento Global, que é o grande vilão.
EXPERIMENTO
Roteiro Experimental 02: Indicadores ácido-base.
Materiais:
• ½ repolho roxa de tamanho médio
• Água
• 1 panela
• 1 garrafa PET transparente de 250 mL, limpa e com tampa
• 1 conjunto de jarra e peneira que se encaixem uma na outra
• 1 frasco com conta-gotas limpo e seco
• 6 copinhos de vidro pequenos (desses de tomar café)
• 6 etiquetas brancas ou pedaços de esparadrapo
• Vinagre branco
• Água da chuva
• Água de cal (cal encontra-se em casas de materiais de construção)
• Solução de bicarbonato de sódio (encontra-se em farmácia e
supermercado)
• Refrigerante tipo soda
• Desinfetante com amoníaco
Procedimento:
1. Corte o repolho em pedaços pequenos, coloque-os na panela e cubra-os com
água. Leve ao fogo e deixe ferver até que a água se reduza a praticamente
metade do volume inicial. Desligue o fogo, tampe a panela e espere esfriar.
Apoie a peneira na jarra e coe o conteúdo da panela. Passe a solução da jarra
para a garrafa PET.
2. Coloque a solução de extrato de repolho-roxo nos copinhos até cerca de 1/3 da
capacidade (20mL). Escreva nas etiquetas o nome dos líquidos que serão
testados e cole nos copinhos.
3. Adicione o conteúdo de um conta-gotas cheio de vinagre branco ao copinho que
possui a etiqueta “vinagre branco”. Observe. Anote suas observações. Faça o
mesmo em relação aos outros líquidos.
4. Não se esqueça de lavar muito bem o conta-gotas antes de testar cada
material para que não haja discrepâncias dos resultados.
5. Há outros indicadores que podemos utilizar, por exemplo, a beterraba. (Uma
beterraba pequena cortada em fatias finas para 100 mL de álcool etílico
92,8°GL). Deixe macerar por 1 h e guarde a solução coada em um frasco limpo e
tampado.
Dados a serem analisados:
1. Classifique os materiais que você testou em um dos seguintes grupos, conforme a
cor da solução observada:
Cor da solução de extrato de repolho-roxo Grupo testado
Vermelha - Ácido forte
Rosada Ácido - moderado
Roxa - Ácido fraco
Azul - Neutro
Verde Base - fraca
Verde-amarelada - Base forte
2. Anote a cor que cada um dos material obteve e monte uma tabela que mostre a
cor do indicador testado em meio ácido, neutro e básico.
3. Esquematize através o processo do experimento através de desenhos, fotos etc.